2022年miRNA新研究进展最新盘点
文章来源: 作者: 发布日期:2022-05-07 浏览次数: 1451 次
Selective inhibition of miRNA processing by a herpesvirus-encoded miRNA
疱疹病毒编码的miRNA选择性抑制miRNA加工
发表期刊:Nature
影响因子:49.962
发表时间:2022年5月4日
疱疹病毒已经掌握了宿主细胞调节和免疫逃避,以增加生产性感染、终生潜伏期和再激活。溶解-潜伏开关与病毒非编码RNAs之间存在着一种长期被重视但尚不明确的关系。本研究确定了病毒microRNA(miRNA)介导的宿主miRNA加工抑制是一种细胞机制,人类疱疹病毒6A(HHV-6A)利用这种机制破坏线粒体结构、逃避宿主内在防御和推动从潜伏病毒感染转变为溶解病毒感染。研究人员证明了病毒编码的miR-aU14通过与各自的初级(pri)-miRNA发夹环直接相互作用,选择性地抑制了多个miR-30家族成员的加工。随后miR-30的丢失和miR-30-p53-DRP1轴的激活引发了线粒体结构的严重破坏。这损害了I型干扰素的诱导,并且对于生产性感染和病毒再激活都是必需的。miR-aU14的异位表达触发了病毒从潜伏期的再激活,将病毒miR-aU14确定为疱疹病毒裂解-潜伏开关的一个易于成药的主要调节因子。本研究结果表明,miRNA介导的miRNA加工抑制代表了一种广泛的细胞机制,可用于选择性地靶向miRNA家族的单个成员。研究人员预计靶向miR-aU14将为预防HHV-6相关疾病中的疱疹病毒再激活提供新的治疗选择。
疱疹病毒编码的miRNA选择性抑制miRNA加工
发表期刊:Nature
影响因子:49.962
发表时间:2022年5月4日
疱疹病毒已经掌握了宿主细胞调节和免疫逃避,以增加生产性感染、终生潜伏期和再激活。溶解-潜伏开关与病毒非编码RNAs之间存在着一种长期被重视但尚不明确的关系。本研究确定了病毒microRNA(miRNA)介导的宿主miRNA加工抑制是一种细胞机制,人类疱疹病毒6A(HHV-6A)利用这种机制破坏线粒体结构、逃避宿主内在防御和推动从潜伏病毒感染转变为溶解病毒感染。研究人员证明了病毒编码的miR-aU14通过与各自的初级(pri)-miRNA发夹环直接相互作用,选择性地抑制了多个miR-30家族成员的加工。随后miR-30的丢失和miR-30-p53-DRP1轴的激活引发了线粒体结构的严重破坏。这损害了I型干扰素的诱导,并且对于生产性感染和病毒再激活都是必需的。miR-aU14的异位表达触发了病毒从潜伏期的再激活,将病毒miR-aU14确定为疱疹病毒裂解-潜伏开关的一个易于成药的主要调节因子。本研究结果表明,miRNA介导的miRNA加工抑制代表了一种广泛的细胞机制,可用于选择性地靶向miRNA家族的单个成员。研究人员预计靶向miR-aU14将为预防HHV-6相关疾病中的疱疹病毒再激活提供新的治疗选择。
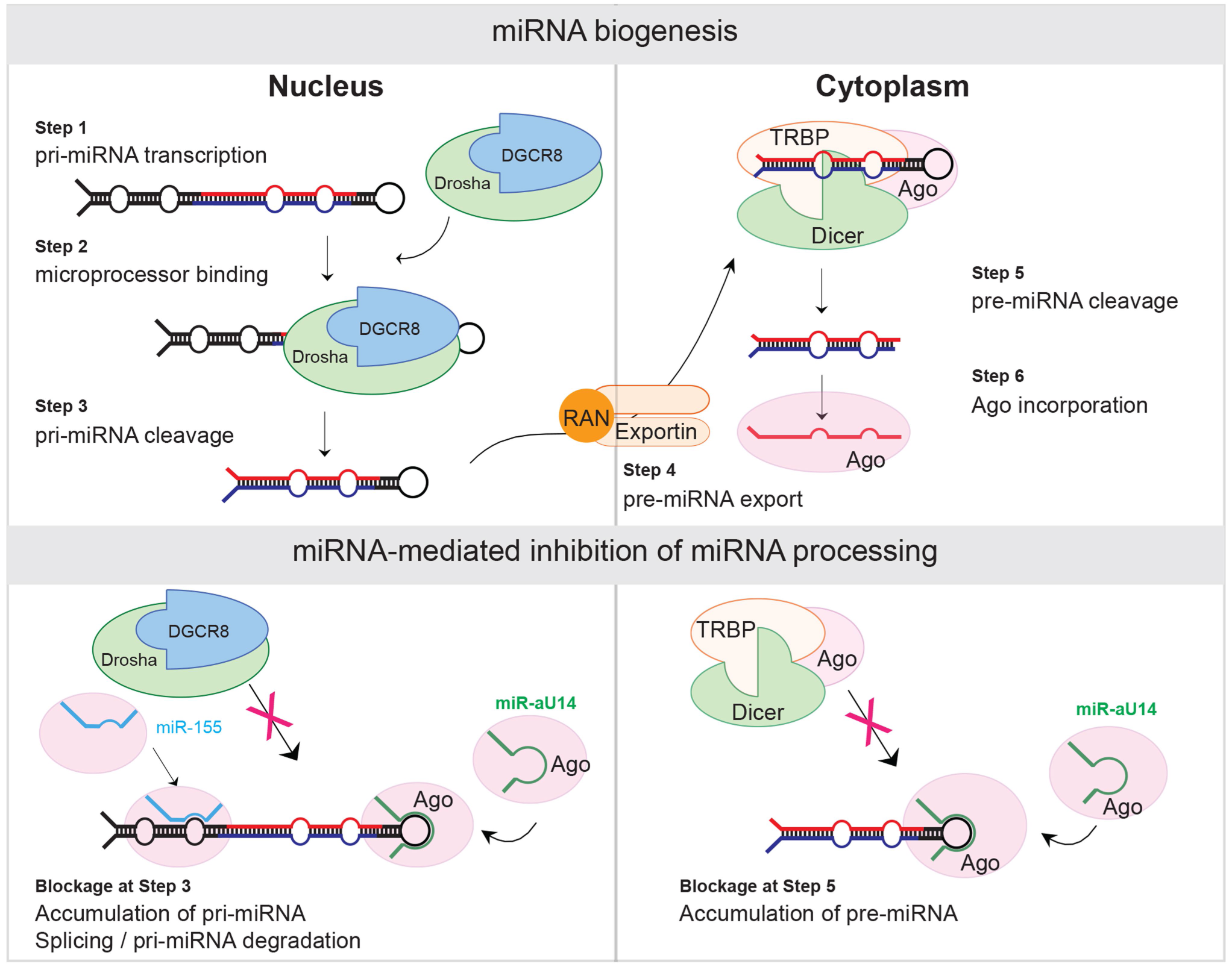
Fig1. miRNA介导的miRNA加工调控示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/35508655/
MiRNA-363-3p/DUSP10/JNK axis mediates chemoresistance by enhancing DNA damage repair in diffuse large B-cell lymphoma
MiRNA-363-3p/DUSP10/JNK轴通过增强弥漫性大B细胞淋巴瘤的DNA损伤修复介导化疗耐药
发表期刊:Leukemia
影响因子:11.528
发表时间:2022年4月29日
基于蒽环类药物的化疗耐药是弥漫性大B细胞淋巴瘤(DLBCL)的主要挑战。本研究通过确定miRNA和基因表达谱(n=47)以揭示潜在的化疗耐药机制和治疗方法。在更大的队列(n=106)中观察并验证了miRNA-363-3p高表达与化疗耐药之间的独立相关性。在体外和体内实验中,通过DLBCL细胞系中的异位表达和CRISPR/Cas9介导的敲除,发现MiRNA-363-3p可减少阿霉素诱导的细胞凋亡和肿瘤收缩。DNA甲基化被发现参与了miRNA-363-3p的转录调控。进一步研究表明,DUSP10(双特异性磷酸酶10)是miRNA-363-3p的靶标,其抑制可促进JNK(c-Jun N-末端激酶)的磷酸化。miRNA-363-3p/DUSP10/JNK轴主要与同源重组(HR)和DNA修复通路的负调控相关。miRNA-363-3p异位表达更有效地修复了阿霉素诱导的双链断裂(DSB),同时增强了非同源末端连接修复,并减少了HR修复。靶向JNK和多聚(ADP-核糖)聚合酶1显著抑制了阿霉素诱导的DSB修复,增加阿霉素诱导的细胞凋亡和肿瘤收缩,并提高荷瘤小鼠的存活率。总之,miRNA-363-3p/DUSP10/JNK轴是DLBCL中一种新的化疗耐药机制,可以通过靶向治疗逆转。
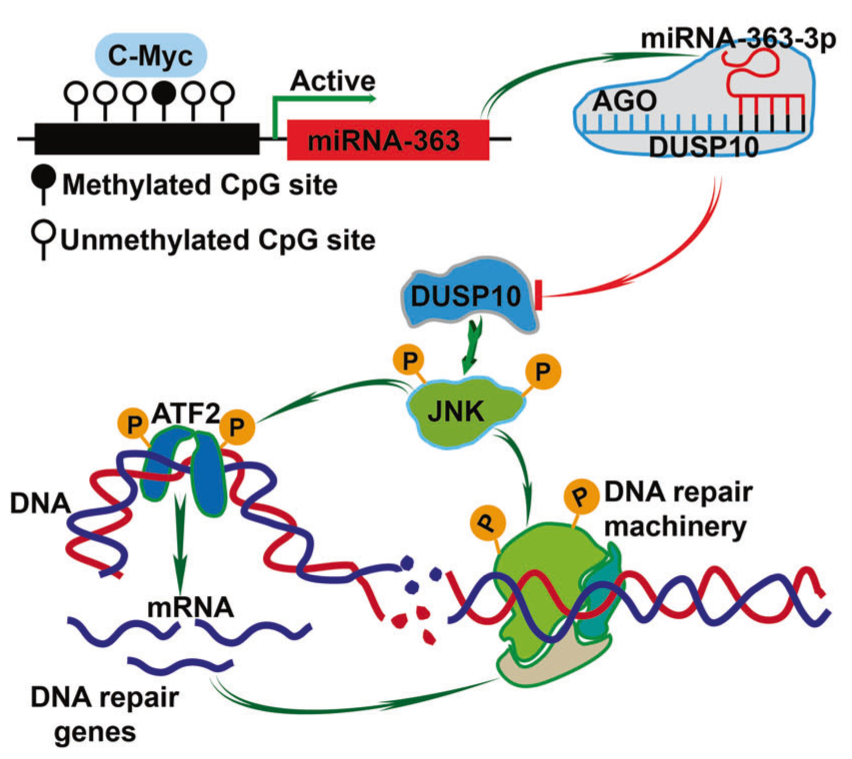
Fig2. miR-363-3p/DUSP10/JNK轴的作用机制示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/35501464/
The microRNA-3622 family at the 8p21 locus exerts oncogenic effects by regulating the p53-downstream gene network in prostate cancer progression
8p21位点的microRNA-3622家族通过调节p53下游基因网络在前列腺癌进展中发挥致癌作用
发表期刊:Oncogene
影响因子:9.867
发表时间:2022年5月2日
对于人类前列腺癌,包含NKX3.1和microRNA(miR)-3622家族(miR-3622a/b)的染色体8p21位点是一个经常缺失的区域。因此,miR-3622被认为是前列腺癌的抑制因子,但其作用仍存在争议。本研究发现人类前列腺癌组织中miR-3622a的表达低于正常前列腺组织,而miR-3622b-3p的表达高于正常前列腺组织。miR-3622a-3p抑制人类前列腺癌细胞的细胞迁移和侵袭,而miR-3622b-3p促进细胞增殖、迁移和侵袭。为了解决miR-3622家族成员在各种人类前列腺癌细胞系中的相反作用,研究人员敲除(KO)内源性miR-3622,包括miR-3622a/b。结果发现,miR-3622 KO可减少体外细胞增殖、迁移和侵袭以及体内肿瘤生长和转移。功能分析显示,miR-3622调节p53下游基因网络,包括AIFM2、c-MYC和p21,从而控制细胞凋亡和细胞周期。此外,使用CRISPR干扰、miRNA/mRNA免疫沉淀实验和双荧光素酶实验,研究人员确定了AIFM2(miR-3622b-3p的直接靶标)负责miR-3622 KO诱导的细胞凋亡。本研究确定了miR-3622-AIFM2轴在肿瘤进展过程中有助于致癌功能。此外,miR-3622 KO通过上调vimentin抑制参与前列腺癌转移的上皮-间质转化。结果表明,miR-3622b-3p在人类前列腺癌中上调,并通过抑制p53信号传导,特别是通过miR-3622-AIFM2轴,在肿瘤进展和转移中具有致癌功能。相反,对于人类前列腺癌,在8p21缺失miR-3622位点会降低了对肿瘤进展和转移的致癌作用。
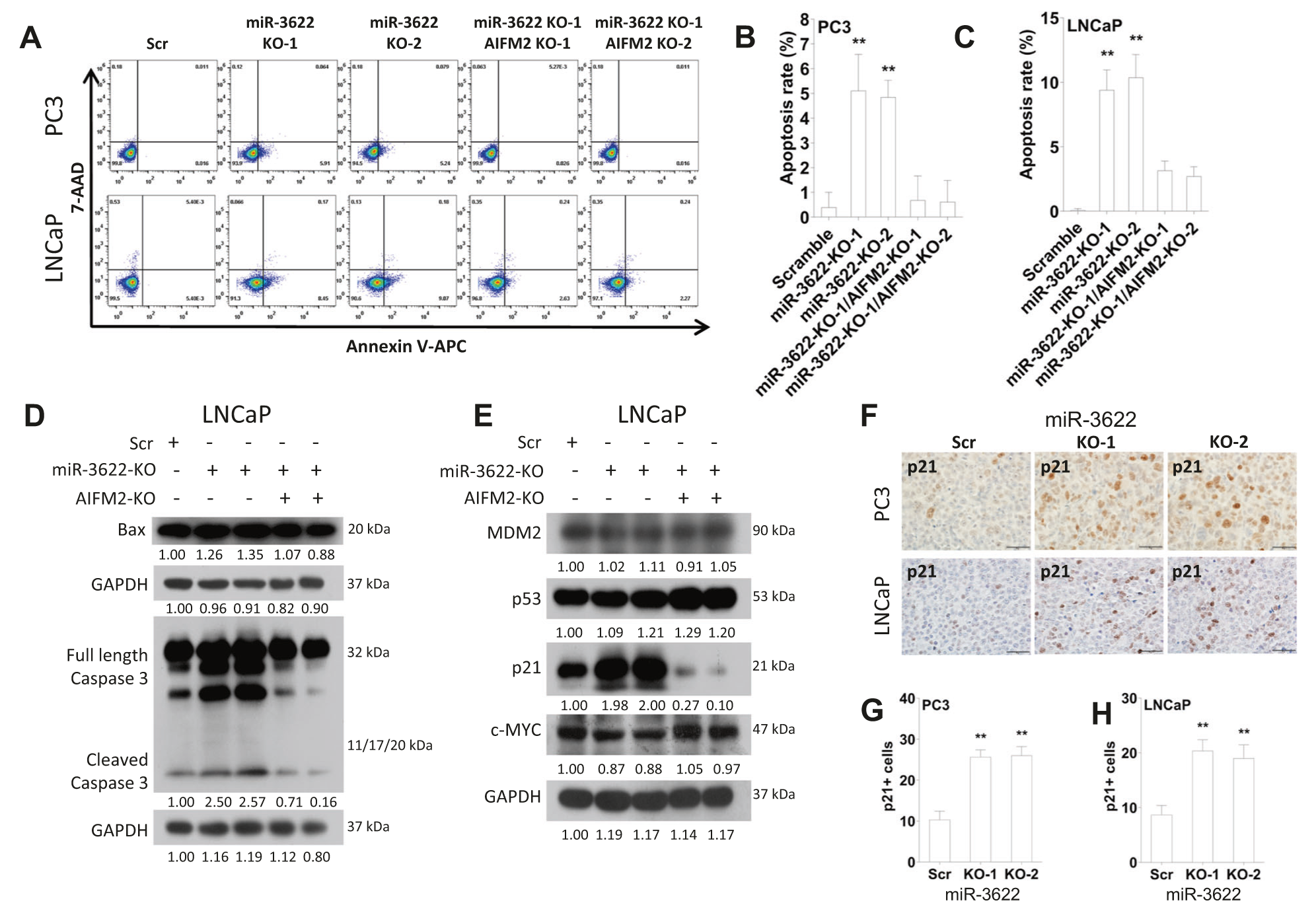
Fig3. miR-3622-AIFM2轴对人类前列腺癌细胞凋亡和p53信号通路激活的影响
原文链接:https://pubmed.ncbi.nlm.nih.gov/35501464/
Reduced miR-371b-5p expression drives tumor progression via CSDE1/RAC1 regulation in triple-negative breast cancer
三阴性乳腺癌中,降低miR-371b-5p表达通过调控CSDE1/RAC1驱动肿瘤进展
发表期刊:Oncogene
影响因子:9.867
发表时间:2022年4月30日
三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌亚型;然而,特异性的预后生物标志物尚未开发出来。本研究通过分析miRNA和mRNA表达来鉴定TNBC中失调的microRNAs(miRNAs)。在TNBC患者中,miR-371b-5p表达降低,而miR-371b-5p过表达显著减轻了TNBC细胞生长、迁移和侵袭。此外,研究发现CSDE1(冷休克结构域蛋白E1)是miR-371b-5p的直接靶基因,其在TNBC细胞中表达上调,抑制CSDE1表达可通过调节RAC1的转录减轻TNBC细胞生长。机制上,CSDE1、RNA聚合酶II(RNAPII)磷酸化C末端结构域(p-CTD)和CDK7形成一个复合物,CSDE1的下调导致RNAPII p-CTD和CDK7之间的相互作用较弱,导致RNAPII p-CTD表达下降,从而降低CSDE1缺陷型TNBC细胞中的RAC1转录水平。本研究结果表明miR-371b-5p是一种肿瘤抑制性miRNA,可调节CSDE1/Rac1轴,可能是TNBC的潜在预后生物标志物。
发表期刊:Oncogene
影响因子:9.867
发表时间:2022年4月30日
三阴性乳腺癌(TNBC)是最具侵袭性的乳腺癌亚型;然而,特异性的预后生物标志物尚未开发出来。本研究通过分析miRNA和mRNA表达来鉴定TNBC中失调的microRNAs(miRNAs)。在TNBC患者中,miR-371b-5p表达降低,而miR-371b-5p过表达显著减轻了TNBC细胞生长、迁移和侵袭。此外,研究发现CSDE1(冷休克结构域蛋白E1)是miR-371b-5p的直接靶基因,其在TNBC细胞中表达上调,抑制CSDE1表达可通过调节RAC1的转录减轻TNBC细胞生长。机制上,CSDE1、RNA聚合酶II(RNAPII)磷酸化C末端结构域(p-CTD)和CDK7形成一个复合物,CSDE1的下调导致RNAPII p-CTD和CDK7之间的相互作用较弱,导致RNAPII p-CTD表达下降,从而降低CSDE1缺陷型TNBC细胞中的RAC1转录水平。本研究结果表明miR-371b-5p是一种肿瘤抑制性miRNA,可调节CSDE1/Rac1轴,可能是TNBC的潜在预后生物标志物。
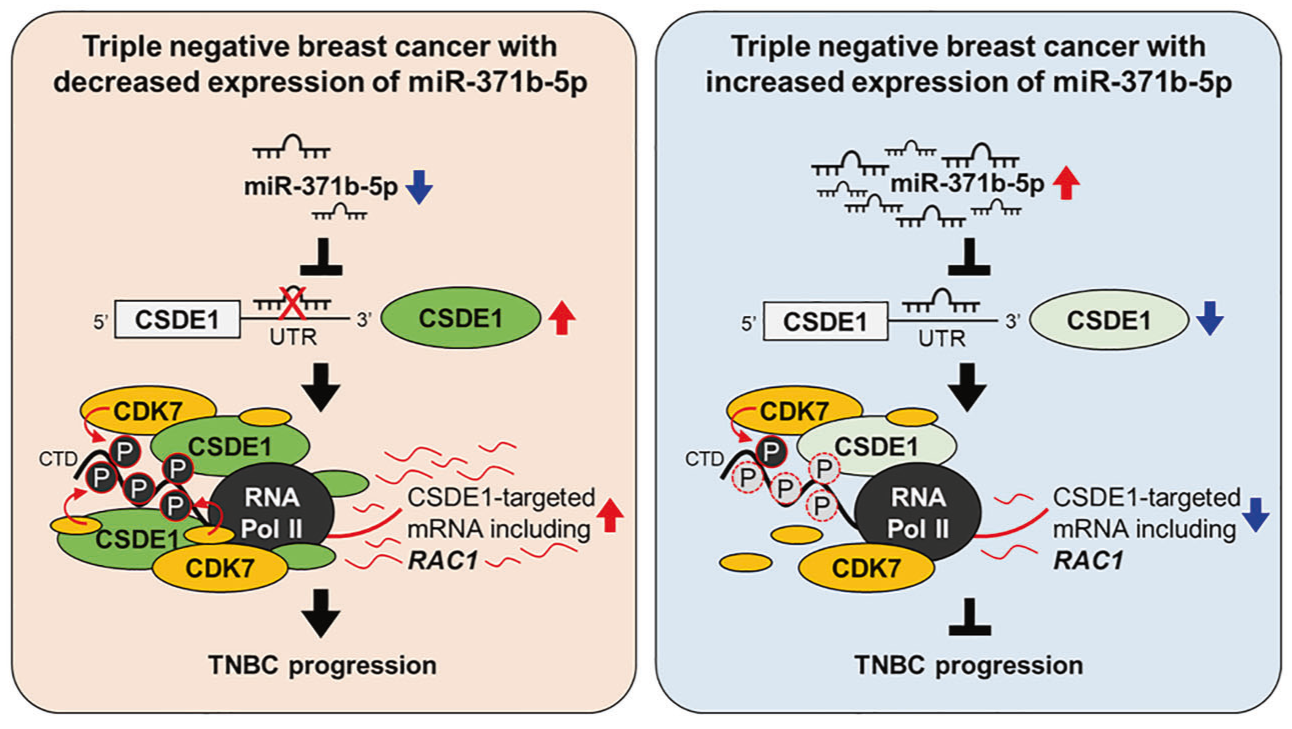
Fig4. TNBC中miR-371b-5p调节的CSDE1-RNAPII(p-CTD)-CDK7/Rac1轴的示意图
原文链接:https://pubmed.ncbi.nlm.nih.gov/35490208/
The dual role of glioma exosomal microRNAs: glioma eliminates tumor suppressor miR-1298-5p via exosomes to promote immunosuppressive effects of MDSCs
胶质瘤外泌体microRNAs的双重作用:胶质瘤通过外泌体消除肿瘤抑制因子miR-1298-5p以促进MDSCs的免疫抑制作用
发表期刊:Cell Death Dis
影响因子:8.469
发表时间:2022年5月2日
明确的证据表明,肿瘤可以通过外泌体分泌microRNAs(miRNAs)来调节肿瘤微环境(TME)。然而,将特定miRNAs分选入外泌体的机制仍不清楚。为了研究外泌体miRNAs的生物学功能和特性,研究人员对59例患者的全程脑脊液(CSF)小细胞外囊泡(sEV)和匹配的神经胶质瘤组织样本进行了全转录组测序。结果表明,miRNAs可分为外泌体富集的miRNAs(ExomiRNAs)和细胞内保留的miRNAs(CLmiRNAs),而外泌体富集的miRNAs通常发挥双重作用。其中,在体外和体内实验中,miR-1298-5p富集于CSF外泌体并抑制胶质瘤进展。有趣的是,外泌体miR-1298-5p可以促进髓源性抑制细胞(MDSCs)的免疫抑制作用,从而促进神经胶质瘤。因此,研究人员发现miR-1298-5p对胶质瘤细胞和MDSCs有不同的作用。机制上,下游信号通路分析表明,miR-1298-5p分别通过靶向SETD7和MSH2在胶质瘤细胞和MDSCs中发挥不同的作用。此外,研究人员对细胞内保留的miRNA miR-9-5p进行了反向验证。总之,本研究证实了胶质瘤细胞中的肿瘤抑制性miRNAs可以通过外泌体消除,并靶向肿瘤相关免疫细胞以诱导肿瘤促进表型。胶质瘤可以从中获得双重好处。这些发现揭示了胶质瘤选择性地将miRNAs分选入外泌体并调节肿瘤免疫的机制。
发表期刊:Cell Death Dis
影响因子:8.469
发表时间:2022年5月2日
明确的证据表明,肿瘤可以通过外泌体分泌microRNAs(miRNAs)来调节肿瘤微环境(TME)。然而,将特定miRNAs分选入外泌体的机制仍不清楚。为了研究外泌体miRNAs的生物学功能和特性,研究人员对59例患者的全程脑脊液(CSF)小细胞外囊泡(sEV)和匹配的神经胶质瘤组织样本进行了全转录组测序。结果表明,miRNAs可分为外泌体富集的miRNAs(ExomiRNAs)和细胞内保留的miRNAs(CLmiRNAs),而外泌体富集的miRNAs通常发挥双重作用。其中,在体外和体内实验中,miR-1298-5p富集于CSF外泌体并抑制胶质瘤进展。有趣的是,外泌体miR-1298-5p可以促进髓源性抑制细胞(MDSCs)的免疫抑制作用,从而促进神经胶质瘤。因此,研究人员发现miR-1298-5p对胶质瘤细胞和MDSCs有不同的作用。机制上,下游信号通路分析表明,miR-1298-5p分别通过靶向SETD7和MSH2在胶质瘤细胞和MDSCs中发挥不同的作用。此外,研究人员对细胞内保留的miRNA miR-9-5p进行了反向验证。总之,本研究证实了胶质瘤细胞中的肿瘤抑制性miRNAs可以通过外泌体消除,并靶向肿瘤相关免疫细胞以诱导肿瘤促进表型。胶质瘤可以从中获得双重好处。这些发现揭示了胶质瘤选择性地将miRNAs分选入外泌体并调节肿瘤免疫的机制。
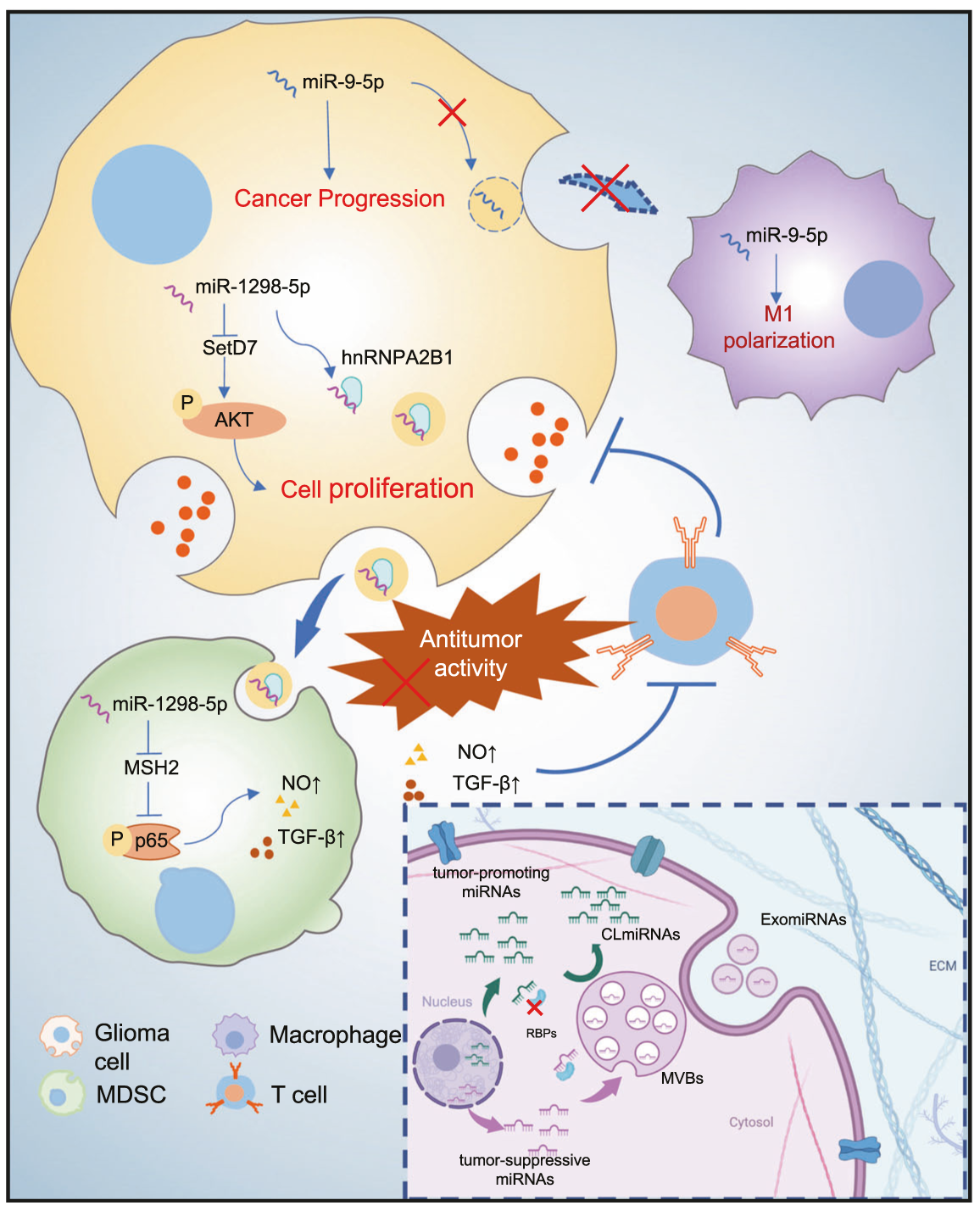
Fig5. 胶质瘤选择性地将抑癌基因miR-1298-5p分选入外泌体,外泌体miR-1298-5p可以促进MDSCs的免疫抑制作用
原文链接:https://pubmed.ncbi.nlm.nih.gov/35501306/





























