CODEX助力医药企业完成eCTD递交
eCTD递交
我国药品申报管理已正式进入eCTD时代
eCTD发展历程
药品注册申报的发展历程—纸质递交到电子递交
药品注册申报的发展历程,可以追溯到早期药品监管法的形成。19世纪初期,随着工业社会的发展,医药工业也在迅速发展。然而,医药市场却出现了混乱状况。处方药中添加物标准不明,标签中所列药物成分模糊,药品误用滥用普遍存在。20世纪中期,一个治疗孕吐的药物“反应停”产生的副作用,导致了无数畸形婴儿的诞生。至此,各国药监机构意识到药品监管已经刻不容缓,纷纷出台有关药品临床及上市申请的监管及注册法规,旨在评估待上市药品的安全性和有效性。由此,药品注册申报应运而生。
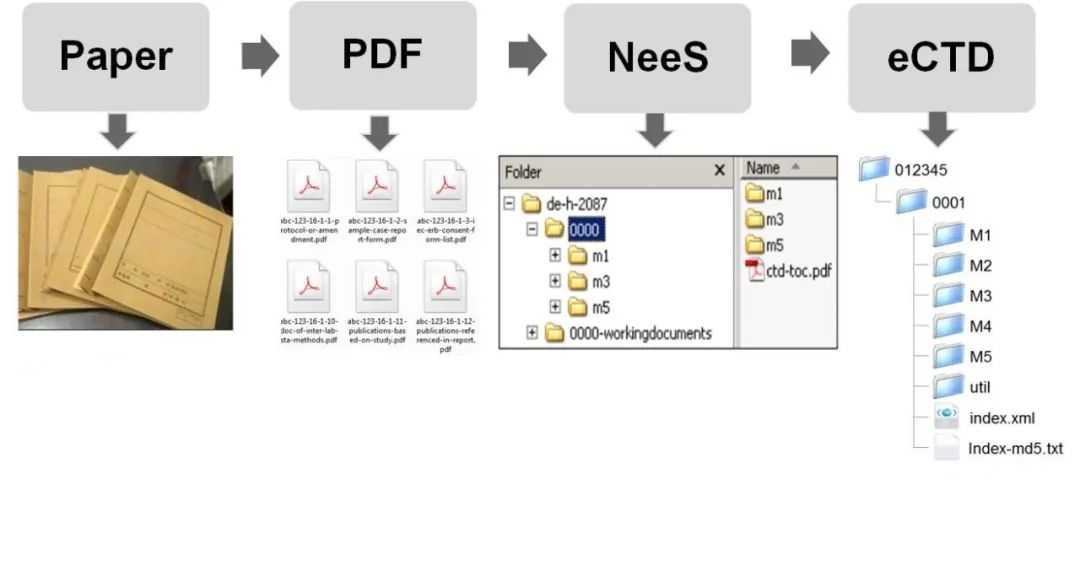
药品注册申报中,申请人主要向监管机构提供研发药品进行临床实验及药品上市申请的相关说明性文档及证明性文件。一个新药的研发从化合物筛选、早期实验室研究、动物实验、人用临床试验到最终成为药品上架往往要经历十年时间,期间产生的数据和文档不计其数。起初,药品注册文档是以纸质的形式由申请人向监管机构进行递交。一次申报文件少则几十卷,多则数百近千卷。而如果要包含涉及临床试验的各种草案及安全数据,申请资料的数目则更为庞大。因此,在美国FDA的大门口经常可以看到用卡车拉来的一箱箱的申请材料,而审阅官的办公桌也总是被各种申报材料所占据。长期积累的申报材料给药监部门带来了很大的库存负担,资料保存也存在巨大风险,并且审阅官查阅资料和审阅效率也越来越低。
随着科技进步与计算机科学的发展,电子文档、无纸化办公出现。药品申报材料也由传统的纸质递交逐渐转为PDF电子文档递交。申请方在递交申报资料时,可以将成套的PDF文件或文件夹刻入光盘,送至监管部门,而无需再进行繁重的打印装订及运输工作。与此同时,PDF文件中的书签及超链接可以为审核官提供文件导航功能,大大提高了审阅效率。如早期在FDA出现的eIND、 eNDA、eBLA等正是运用了此种提交方式。
再后来,加入了更多的计算机技术文档,形成了我们今日倡导的eCTD格式文档。较之PDF文件递交和NeeS格式递交,eCTD拥有更多的便捷性。比如index.xml的加入,省去了Comprehensive TOC (总体目录),md5 checksum为文档提供安全数字指纹,保证了其在传输过程中的完整性。另外,在传输方式上,也由原来的寄送文件夹或光盘改为电子通道Gateway的形式。毋庸置疑,相较于以上几种递交方式,eCTD在注册文件的创建、传输、审阅、存档、检索、再利用、生命周期管理等方面存在诸多优势,在效率、成本、便捷度等方面优势明显。这些显而易见的优势都促成了eCTD逐步成为全球药品注册申报的重要手段。
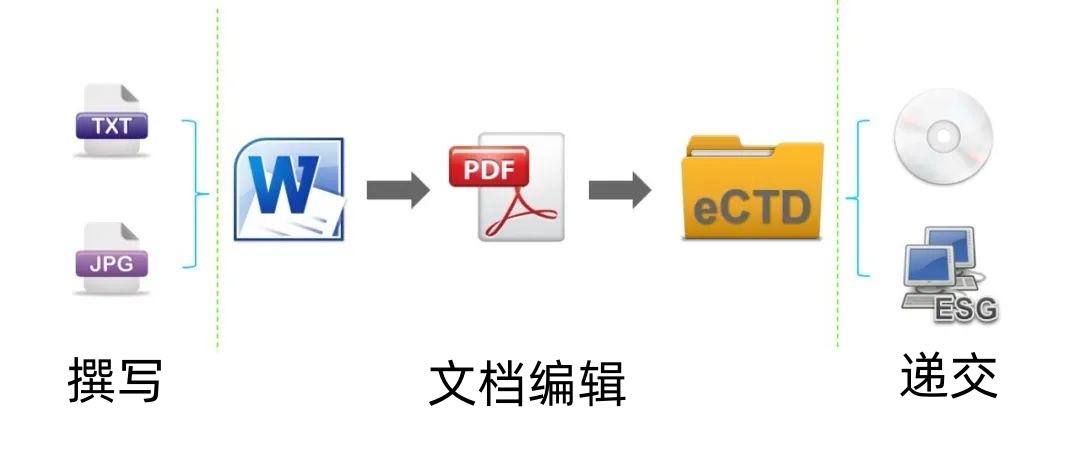
eCTD制作流程
eCTD电子递交流程上大体可以分为三个阶段:
1)撰写(Authoring)
2)文档编辑(Dossier Publishing)
3)递交(Submitting)
第一阶段的撰写工作一般由RA(Regulatory Affairs)团队完成,主要是汇集各方资料、数据、实验记录等等,然后进行申报资料的撰写。一般涉及的文件类型有MS Word(如,Study Report,Summary等),JPEG类图片文档(如扫描的实验记录、图谱、批记录等)。这一阶段,最为关注的是文档的技术内容、语言表达,是申报文件的“灵魂”。
第二阶段的文档编辑工作一般由RO(Regulatory Operation)团队或第三方的专业编辑服务外包商完成,主要是将第一阶段的文档进行格式编辑,并根据相关法规要求构建eCTD结构化文档。这期间,文档会经历从MS Word到PDF再到eCTD结构化文档的过程。这些编辑工作十分细致与耗时,且对文档编辑人员(Publisher)的法规知识及操作技能要求很高,某些环节更是需要软件工具来实现或者提高工作效率与准确度。这一阶段,关注点由内容的技术性转为文档的格式与合规性,是打造申报文件的“外表”和规范“着装”的过程。
第三阶段的递交传输一般是由申报负责人(Submission Manager)完成。通过事先建立好的电子传输通道, 如ESG, CESP等,将申报文件安全地递交到药监部门,并确认正确的文档版本被成功递送和接收。这一阶段,最为关注的是文档数据的安全完整传输,保证申报文件在药监机构能完美全面地“登台展现”。
以上三个阶段,最为耗时和复杂的是文档编辑工作。
下面我们就来具体看看这部分如何进行。
按照文件类型,我们把编辑工作再分成三个步骤:
1)Word文档格式化编辑
撰写好的Word文档要进行两个检查:一为内容检查(Content QC),二为格式检查(Format QC)。
这里的内容检查并非指技术内容的检查,而是指内容“表达”的检查,比如,数字和单位叠加的表达(three 5 L flasks into four 3 L flasks;3,4,5 kg),缩略语和大小写是否规范,日期时间的格式是否统一,上下角标,用词规范,拼写错误,以及文档命名规范等等。
格式检查则主要包括页眉页脚页边距,字体字号,标题,图表和目录的格式是否合乎规范等。
2)PDF文档编辑
Word文件检查通过之后,就可以转换为PDF文件了。根据相关法规要求,eCTD格式化申报文档中的PDF文件须添加书签(Bookmark)和超链接(Hyperlink),以便实现快速导航。此外,还需要对PDF文档进行一些设置以符合要求(如,文件打开视图方式,书签展开级别,单个文档大小上限等)。申报文档中的书签和超链接数量往往很多,手动生成不但耗时并且准确性难以控制。一个能自动生成书签和超链接的软件工具可以帮助文档编辑大幅度提高工作效率和准确性。
3)eCTD构建和生成
当所有的PDF文件编辑完毕后,我们称此时的PDF文件已经进入submission ready的状态,意味着可以真正进入eCTD的制作了。
从技术角度来看,eCTD的构建和生成是最有难度的一个步骤,由于涉及了诸多计算机语言,普通文档编辑员是无法通过手动编写代码来生成最终的eCTD格式化文档的。因此对于这一步的操作来说,eCTD软件工具是必需的。
大多数的eCTD编辑生成软件都是按照ICH和各药监机构的法规要求来开发的,因此在构建eCTD结构骨架时,用户只需按照软件的导向窗口,正确填写相关参数,软件即可自动生成eCTD结构树。之后编辑员只需将需要提交的PDF文档拖拽添加到结构树上,再添加文档之间的外链,最后按照软件提示填写汇编参数,软件就可以自动生成最终的eCTD结构化文档。同时,有些软件会按照相关法规要求自动检查合规性并生成结果报告(比如,是否有书签缺失,超链接断链,文档名错误,单个文档大小超限等等。)如果确实有报错的问题,编辑员根据提示做相应修改,并重新汇编生成即可。
以上是一个标准eCTD格式化文档的编辑步骤。当然,要制作一套合规的eCTD文档,还需要合理的流程设计,合规的软件应用,注册人员对格式法规的熟悉,以及熟练的计算机操作能力。
eCTD注册申报流程
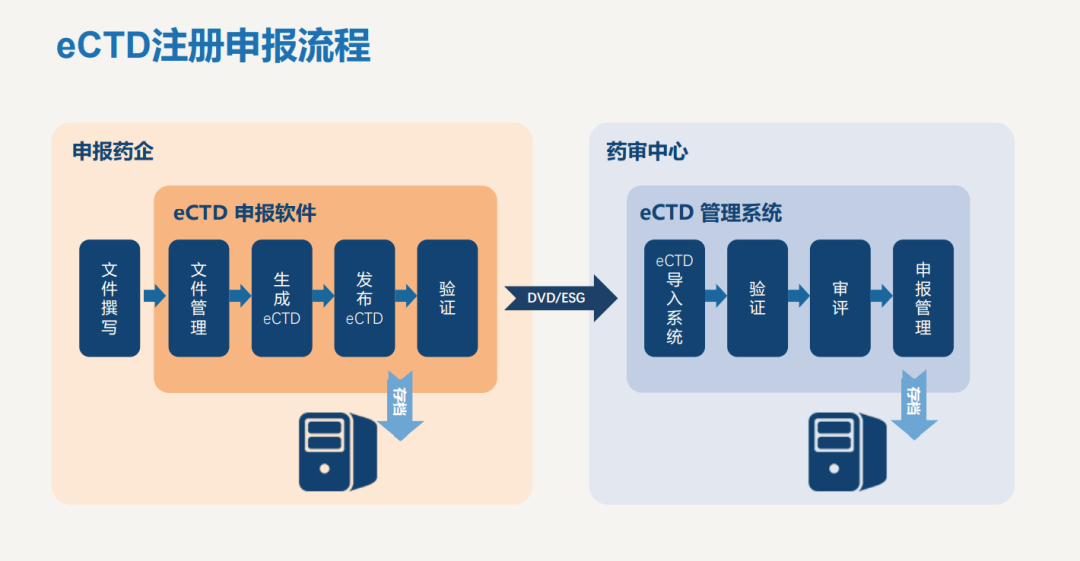
CODEX配备了符合ICH和中国NMPA要求的全生命周期管理的eCTD电子递交系统,可为医药企业提供一整套建立、审阅、验证和发布全流程eCTD电子提交解决方案。CODEX电子递交事务部能够帮助研发申报人员提高工作效率, 缩短申报周期, 保障申报过程合规, 助力广大医药企业高效完成注册, 加速产品评审。同时,CODEX电子递交事务部也可为申请人提供专业的eCTD制作外包服务,让企业更快了解掌握eCTD相关流程。





























