6月起!实施这些医疗器械新规
6月起,一批医疗器械新规/标准施行,与企业息息相关。
01 第三类医疗器械(含IVD)无UDI码将无法上市
6月1日起,生产的三类器械(含IVD)无UDI码将无法上市。国家药监局、国家卫健委、国家医保局联合印发的《关于做好第二批实施医疗器械唯一标识工作的公告》将其余第三类医疗器械(含体外诊断试剂)纳入第二批实施唯一标识范围。
根据《公告》,2022年6月1日起,生产的医疗器械应当具有医疗器械唯一标识;申请首次注册、延续注册或者注册变更时,注册申请人/注册人应当在注册管理系统中提交其最小销售单元的产品标识;2022年6月1日起生产的医疗器械,在其上市销售前,注册人应当按照相关标准或者规范要求将最小销售单元、更高级别包装的产品标识和相关数据上传至医疗器械唯一标识数据库,确保数据真实、准确、完整、可追溯。
《公告》特别指出,医疗器械注册人要切实落实企业主体责任,鼓励基于唯一标识UDI建立健全追溯体系,做好产品召回、追踪追溯等有关工作。医疗器械经营企业要在经营活动中积极应用唯一标识,做好带码入库、出库,实现产品在流通环节可追溯。医疗机构要在临床使用、支付收费、结算报销等临床实践中积极应用唯一标识,做好全程带码记录,实现产品在临床环节可追溯。
未按要求执行,或将罚款十万
需要注意的是,根据新版《医疗器械生产监督管理办法》第三十六条,医疗器械注册人、备案人、受托生产企业应当按照国家实施医疗器械唯一标识的有关要求,开展赋码、数据上传和维护更新。第七十九条,未按照国家实施医疗器械唯一标识的有关要求,组织开展赋码、数据上传和维护更新等工作的,由药品监督管理部门依职责责令限期改正;拒不改正的,处1万元以上5万元以下罚款;情节严重的,处5万元以上10万元以下罚款。此外,新版《医疗器械经营监督管理办法》第三十条也规定,医疗器械经营企业应当按照国家有关规定执行医疗器械唯一标识制度,应当建立并实施产品追溯制度,保证产品可追溯。
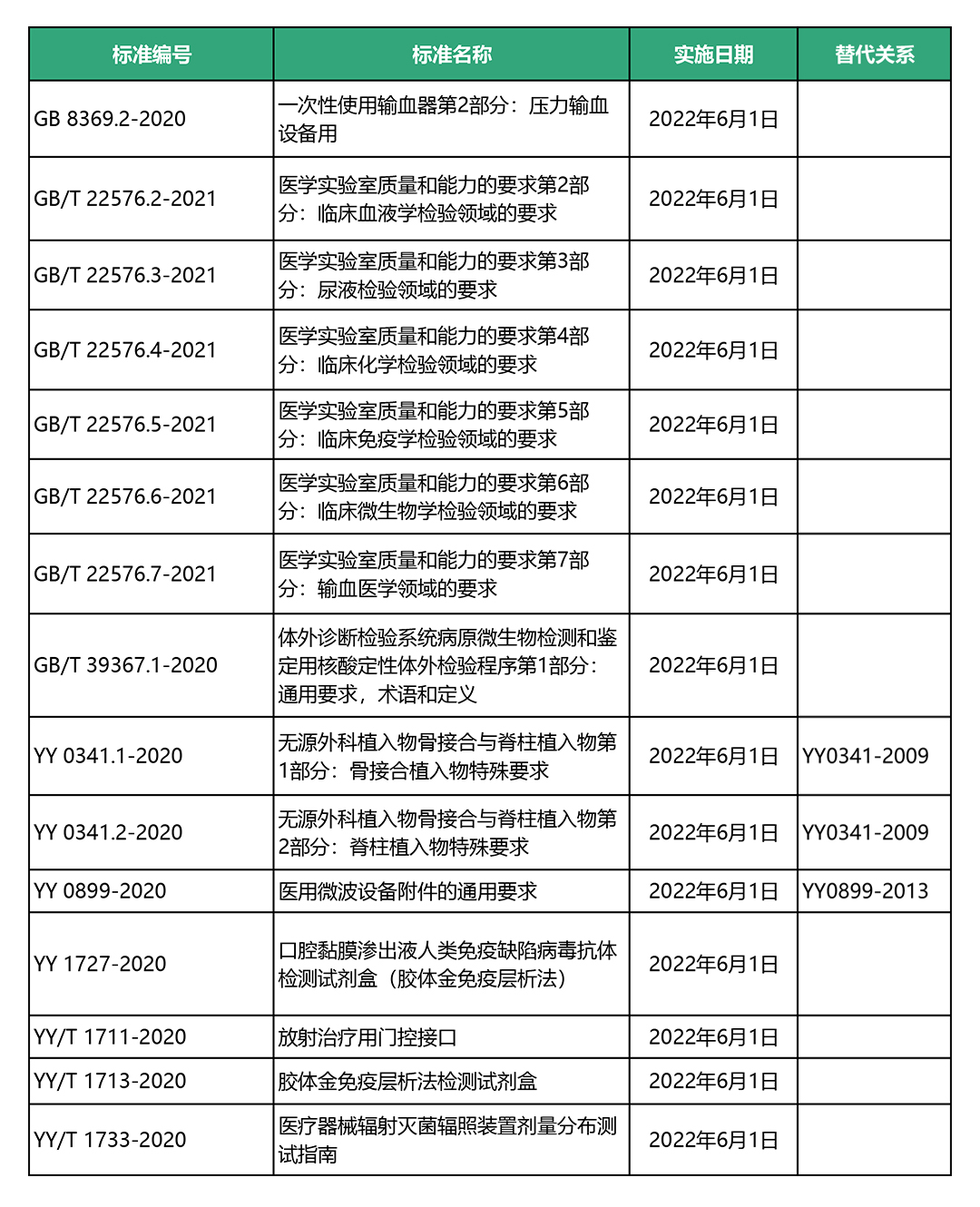
02 15项医疗器械新标准开始施行
6月1日起,15项医疗器械新标准开始施行,目录如下:
注:您可以在以下两个网站查询上述标准
国家标准全文公开系统http://openstd.samr.gov.cn/bzgk/gb/index
全国标准信息公共服务平台
http://std.samr.gov.cn/
03 妇幼保健机构需配备15类医用设备
国家卫健委发布推荐性卫生行业标准《妇幼保健机构医用设备配备标准》自2022年6月1日起施行。标准确立了各级妇幼保健机构医用设备配备的总体要求和基本原则,要求科学、合理、经济、有效地配备各类妇幼保健医用设备。标准指出,按照妇幼保健机构功能定位和服务需求,机构须配齐的设备种类包括孕产保健设备、妇女保健设备、急诊急救设备、功能检查设备、影像检查设备、生物理化检验设备、手术室麻醉室设备、信息化设备等15类。





























